Análisis del genoma de un virus atípico de influenza aviar H5N2 de baja patogenicidad de origen mexicano
Contenido principal del artículo
Resumen
Veterinaria México OA
ISSN: 2448-6760
Cómo citar este artículo:
- Steffani Hernández G, Chávez Maya F, Rojas Anaya E, Loza Rubio E, García Espinosa G. Análisis del genoma de un virus atípico de influenza aviar H5N2 de baja patogenicidad de origen mexicano. Veterinaria México OA. 2016;3(2). doi: 10.21753/vmoa.3.2.363
Este estudio analizó el genoma de un virus de influenza aviar H5N2, aislado de heces de pollos tipo Leghorn y patos Pekín, infectados experimentalmente para conocer su origen y características moleculares. La secuencia completa del genoma del virus se obtuvo por medio del método de secuenciación de Sanger, una vez obtenida la secuencia, se caracterizó mediante comparación genética y análisis filogenético. Los resultados del análisis mostraron que los ocho segmentos del genoma están relacionados con virus aislados en México. El análisis del gen de la hemoaglutinina reveló que codifica para pocos aminoácidos básicos en el sitio de corte y quizá carece de un sitio de glicosilación en la posición once. El gen que codifica para la proteína PB1 carece del fragmento PB1-F2, así como en el gen de la PA se encuentra el fragmento PA-X. También se observó, que el gen de la polimerasa contiene la secuencia consenso del ribosoma TCC TTT CGT C, requerida para la expresión de PA-X. Las características moleculares demostraron que el virus corresponde a un virus de baja patogenicidad del subtipo H5 con excepción del posible sitio once de glicosilación. La información del genoma para esta cepa del virus, proveerá un mapa molecular para futuros estudios in vivo que puedan contribuir a conocer por qué algunos virus de influenza aviar persisten en los pollos por periodos prolongados. Esta información puede ser de utilidad en países como México, donde el virus ha estado en la avicultura desde 1994 y con el potencial de evolucionar a virus de alta patogenicidad.

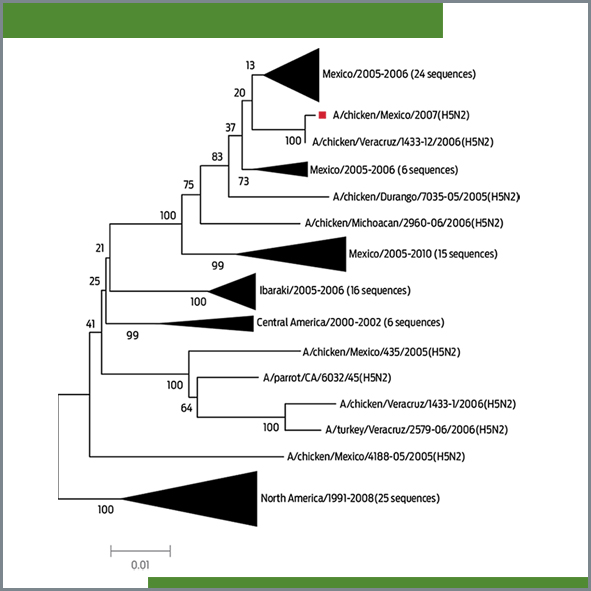
 ]. El árbol filogenético se construyó a través del método de Neighbor-joining. Los porcentajes de cada rama donde están representados los grupos taxonómicos con 1000 replicas se expresan cerca de las ramas. Las distancias evolutivas se obtuvieron por el método de 2-parámetros de Kimura. El análisis incluyó 101 secuencias de nucleótidos de pollos. El análisis evolutivo se hizo con el programa MEGA 5.05. En las figuras, cada triángulo representa grupos de secuencias estrechamente relacionados, donde el tamaño del triángulo se conecta de forma directa con el número de secuencias colapsadas.
]. El árbol filogenético se construyó a través del método de Neighbor-joining. Los porcentajes de cada rama donde están representados los grupos taxonómicos con 1000 replicas se expresan cerca de las ramas. Las distancias evolutivas se obtuvieron por el método de 2-parámetros de Kimura. El análisis incluyó 101 secuencias de nucleótidos de pollos. El análisis evolutivo se hizo con el programa MEGA 5.05. En las figuras, cada triángulo representa grupos de secuencias estrechamente relacionados, donde el tamaño del triángulo se conecta de forma directa con el número de secuencias colapsadas.
Detalles del artículo
Citas
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ. 1990. Basic local alignment search tool. Journal of Molecular Biology, 215:403-410.
Armas Bojórquez E, Rojas Anaya E, Diosdado Vargas F, García Espinosa G, Loza-Rubio E. 2015. Evaluation of polyvalent vaccine obtained from divergent low pathogenic H5N2 isolates of the avian influenza virus in Mexico. SM Vaccines and Vaccination Journal, 1:1010.
Berhane Y, Joseph T, Kehler H, Hisanaga T, Embury-Hyatt C, Diederich S, Hooper McGreevy K, Handel K, Cottam-Birt C, Pasick J. 2014. Characterization of a low pathogenic avian influenza H5N2 virus isolated from a turkey breeder flock in Manitoba, Canada. Avian Diseases, 58(1):1-7. DOI: 10.1637/10591-061213-Reg.1. http://dx.doi.org/10.1637/10591-061213-Reg.1
Carranza-Flores JM, Padilla-Noriega L, Loza-Rubio E, García-Espinosa G. 2013. Prolonged excretion of a low-pathogenicity H5N2 avian influenza virus strain in the Pekin duck. Journal of Veterinary Science, 14:487-490. DOI: 10.4142/jvs.2013.14.4.487. http://dx.doi.org/10.4142/jvs.2013.14.4.487
Causey D, Edwards SV. 2008. Ecology of avian influenza virus in birds. Journal of Infectious Diseases, 197:S29-33.
Chang-Chun DL, Huachen Z, Pei-Yu H et al. 2014. Emergence and evolution of avian H5N2 influenza viruses in chickens in Taiwan. Journal of Virology, 88(10):5677-5686. DOI: 10.1128/JVI.00139-14. http://dx.doi.org/10.1128/JVI.00139-14
Deshpande KL, Fried VA, Ando M, Webster RG. 1987. Glycosylation affects cleavage of an H5N2 influenza virus hemagglutinin and regulates virulence. Proceedings of the National Academy of Science of the United States of America, 84:36-40.
Escorcia M, Carrillo-Sánchez K, March-Mifsut S, Chapa J, Lucio E, Nava GM. 2010. Impact of antigenic and genetic drift on the serologic surveillance of H5N2 avian influenza viruses. BioMed Central Veterinary Research, 6:57. DOI: 10.1186/1746-6148-6-57. http://dx.doi.org/10.1186/1746-6148-6-57
Gasteiger E, Gattiker A, Hoogland C, Ivanyi I, Appel RD, Bairoch A. 2003. ExPASy: the proteomics server for in-depth protein knowledge and analysis. Nucleic Acids Research, 31:3784-3788. DOI: 10.1093/nar/gkg563
Ha Y, Stevens DJ, Skehel JJ, Wiley DC. 2001. X-ray structures of H5 avian and H9 swine influenza virus hemaglutinins bound to avian and human receptor analogs. Proceedings of the National Academy of Science of the United States of America, 98(20):11181-11186. DOI: 10.1073/pnas.201401198. http://dx.doi.org/10.1073/pnas.201401198
Hayashi T, MacDonald LA, Takimoto T. 2015. Influenza A virus protein PA-X contributes to viral growth and suppression of the host antiviral ad immune responses. Journal of Virology, 89(12):6442-6452. http://dx.doi:10.1128/JVI.00319-15
Hu J, Mo Y, Wang X, Gu M, Hu Z, Zhong L, Wu Q, Hao X, Hu S, Liu W, Liu H, Liu X, Liu X. 2015. PA-X decreases the pathogenicity of highly pathogenic H5N1 influenza A virus in avian species by inhibiting virus replication and host response. Journal of Virology, 89(8):4126-4142. http://dx.doi:10.1128/JVI.02132-14
Hoffmann E, Stech J, Guan Y, Webster RG, Perez DR. 2001. Universal primer set for the full-length amplification of all influenza A viruses. Archives of Virology, 146:2275-2289. DOI: 10.1007/s007050170002. http://dx.doi.org/10.1007/s007050170002
Jagger BW, Wise HM, Kash JC, Walters KA, Wills NM, Xiao YL, Dunfee RL, Schwartzman LM, Ozinsky A, Bell GL, Dalton RM, Lo A, Efstathiou S, Atkins JF, Firth AE, Taubenberger JK, Digard P. 2012. An overlapping protein-coding region in influenza A virus segment 3 modulates the host response. Science, 337:199-204. DOI: 10.1126/science.1222213. http://dx.doi.org/10.1126/science.1222213
Lee CW, Senne DA, Suarez DL. 2004. Effect of vaccine use in the evolution of Mexican lineage H5N2 avian influenza virus. Journal of Virology, 78(15):8372-8381. DOI: 10.1128/JVI.78.15.8372-8381.2004. http://dx.doi.org/10.1128/JVI.78.15.8372-8381.2004
Li J, Dohna H, Cardona CJ, Miller J, Carpenter TE. 2011. Emergence and genetic variation of neuraminidase stalk deletions in avian influenza viruses. PLoS One, 6:e14722. DOI: 10.1371/journal.pone.0014722. http://dx.doi.org/10.1371/journal.pone.0014722
Li Q, Wang X, Sun Z, Hu J, Gao Z, Hao X, Li J, Liu H, Wang X, Gu M, Xu X, Liu, X. 2015. Adaptive mutations in PB2 gene contribute to the high virulence of a natural reassortant H5N2 avian influenza in mice. Virus Research, 210:255-263. http://dx.doi.org/10.1016/j.virusres.2015.08.017
MacAuley JL, Chipuk JE, Boyd KL, Van De Velde N, Green DR, McCullers JA. 2010. PB1-F2 proteins from H5N1 and 20th century pandemic influenza viruses cause immunopathyology. Plos Pathogen, 6:e1001014. http://dx.doi.org/10.1371/journal.ppat.1001014
Marjuki H, Scholtissek C, Franks J, Negovetich NJ, Aldridge JR et al. 2010. Three amino acid changes in PB1-F2 of highly pathogenic H5N1 avian influenza virus affect pathogenicity in mallard ducks. Archives of Virology, 155:925-934.
Neumann G, Kawaoka Y. 2011. Influenza Viruses: Molecular Virology. Encyclopedia of Life Sciences. DOI: 10.1002/9780470015902.a0001031.pub3. http://dx.doi.org/10.1002/9780470015902.a0001031.pub3
Okamatsu M, Saito T, Yamamoto Y, Mase M, Tsuduku S, Nakamura K, Tsukmoto K, Yamaguchi S. 2007. Low parhogenicity H5N2 avian influenza outbreak in Japan during the 2005-2006. Veterinary Microbiology, 124:35-46.
Petrini A, Vallat B. 2009. Notification of avian influenza and newcastle disease to the Organization for Animal Health (OIE). In: Capua I, Alexander DJ. (eds). Avian Influenza and Newcastle Disease. Milan, Italy: Springer-Verlag.
Sanger F, Nicklen S, Coulson AR. 1977. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Science of the United States of America, 74(12):5463-5467.
Soda K, Cheng MC, Yoshida H, Endo M, Lee SH, Okamatsu M, Sakoda Y, Wang CH, Kida H. 2011. A low pathogenic H5N2 influenza virus isolated in Taiwan acquired high pathogenicity by consecutive passages in chickens. Journal of Veterinary Medical Science, 73(6):767-772.
Swayne DE, Perdue ML, Garcia M, Rivera-Cruz E, Brugh M. 1997. Pathogenicity and diagnosis of H5N2 Mexican avian influenza viruses in chickens. Avian Diseases, 41(2):335-346.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. 2011. MEGA5: Molecular Evolutionary Genetics Analysis using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Method. http://www.megasoftware.net/ [access: 07 apr 2014].
Villarreal-Chavez C, Rivera-Cruz E. 2003. An update on avian influenza in Mexico. Avian Diseases, 47(3):1002-1005.
Wood GW, Banks J, Strong I, Parsons G, Alexander DJ. 1996. An avian influenza virus of H10 subtype that is highly pathogenic for chickens, but lacks multiple basic amino acids at the haemagglutinin cleavage site. Avian Pathology, 25:799-806. DOI: 10.1080/03079459608419182. http://dx.doi.org/10.1080/03079459608419182
Zhao G, Gu X, Lu X, Pan J, Duan Z, Zhao K, Gu M, Liu Q, He L, Chen J, Ge S, Wang Y, Chen S, Wang X, Peng D, Wan H, Liu X. 2012. Novel Reassortant highly pathogenic H5N2 avian influenza viruses in poultry in China. PLoS One, 7(9):e46183. DOI: 10.1371/journal.pone.0046183. http://dx.doi.org/10.1371/journal.pone.0046183
License

Veterinaria México OA por Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México se distribuye bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Basada en una obra en http://www.revistas.unam.mx
- Todos los artículos en Veterinaria México OA se publican bajo una licencia de Creative Commons Reconocimiento 4.0 Unported (CC-BY 4.0). Con esta licencia, los autores retienen el derecho de autor, pero permiten a cualquier usuario compartir, copiar, distribuir, transmitir, adaptar y hacer uso comercial de la obra sin necesidad de proporcionar un permiso adicional, siempre y cuando se otorgue el debido reconocimiento al autor o fuente original.
- Al utilizar esta licencia, los artículos en Veterinaria México OA cubren o exceden todos los requisitos fundacionales e institucionales para ser considerados de Acceso Abierto.
- Los autores no pueden utilizar material protegido por derechos de autor en su artículo a menos que ese material esté también disponible bajo una licencia igualmente generosa.