Características histológicas e histoquímicas del intestino delgado en crías de la tortuga caguama (<em>Caretta caretta</em>)
Contenido principal del artículo
Resumen
Veterinaria México OA
ISSN: 2448-6760
Cómo citar este artículo:
- Ontiveros-Tlachi R, Muñoz-Tenería FA, Anzaldúa-Arce SR. Características histológicas e histoquímicas del intestino delgado en crías de la tortuga caguama (Caretta caretta). Veterinaria México OA. 2014;1(1). doi: 10.21753/vmoa.1.1.334.
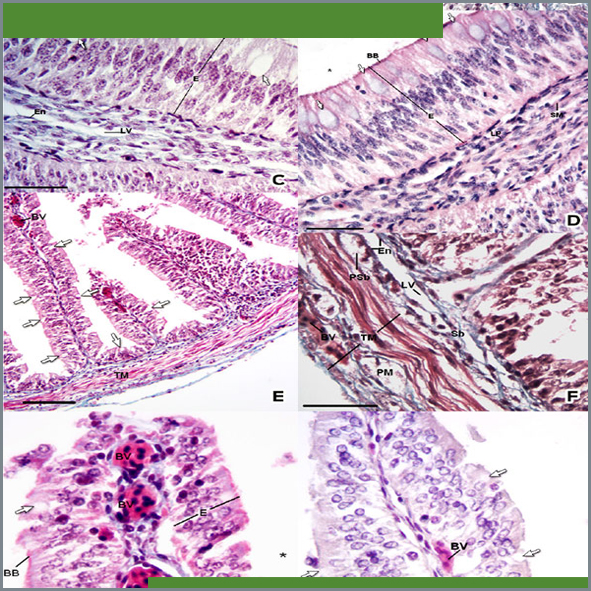
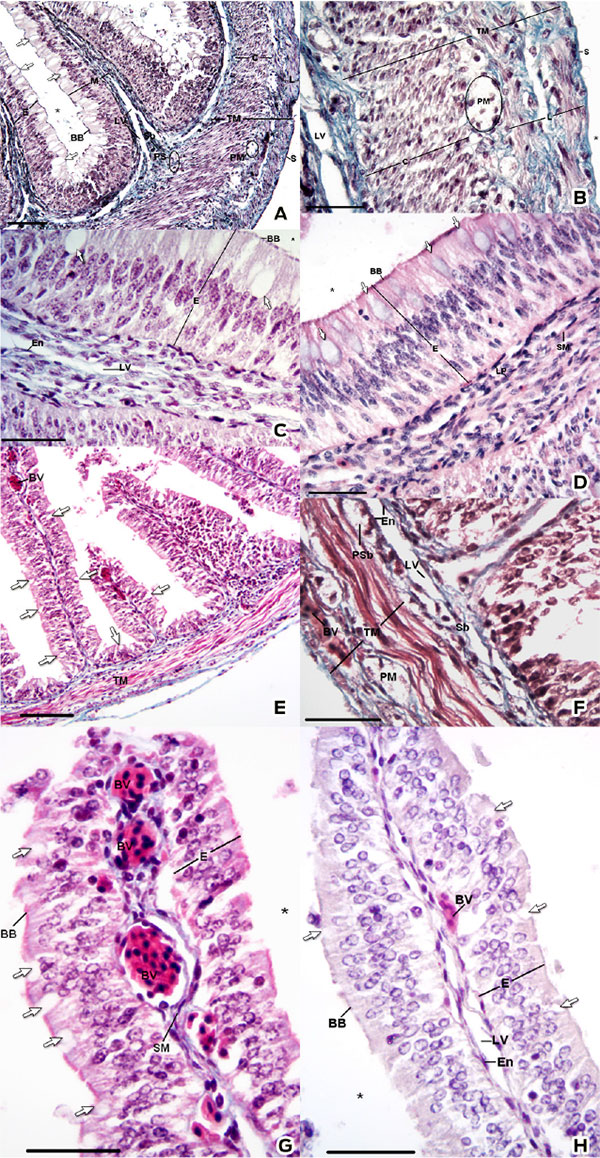
La tortuga caguama (Caretta caretta) es una especie amenazada, por tanto la [investigación básica] es esencial para complementar los esfuerzos de conservación. Con el objeto de generar información en este campo, este trabajo se orientó a la identificación de la morfología microscópica y los aspectos histoquímicos del intestino delgado en crías de tortuga caguama. Debido a su estatus como especie amenazada, se analizaron 4 especímenes muertos. Durante la necropsia, se obtuvieron muestras del intestino delgado en las porciones craneal y caudal. Las muestras se procesaron por el método de inclusión en parafina y se tiñeron por las siguientes técnicas: hematoxilina y eosina, tricrómica de Gomori, ácido peryódico-reactivo de Schiff (PAS), azul alciano (pH 1.0 y pH 2.5), PAS-azul alciano, azul de toluidina (pH 4.5 y pH 3.5), Giemsa, hierro coloidal, azul de Perls, impregnación de Wilder, metenamina de plata, Grimelius y Masson-Fontana. Entre los hallazgos histológicos, los principales fueron: la mucosa intestinal presentó plicas revestidas por un epitelio cilíndrico pseudoestratificado con vasos sanguíneos y en la submucosa se observaron abundantes vasos linfáticos. Los gránulos de secreción de las células caliciformes presentaron las siguientes características: en la porción craneal se observó la presencia de mucopolisacáridos neutros, ácidos sulfatados y con ácido siálico. En la porción caudal se detectó la presencia de mucopolisacáridos neutros y con ácido siálico. A lo largo del intestino se observaron células argentafines, principalmente en la porción craneal. Existen diferencias morfológicas, tanto histológicas como histoquímicas, entre la porción craneal y caudal en el intestino de C. caretta. Estas características se correlacionaron con posibles funciones dentro de la fisiología tisular.
Detalles del artículo
Citas
1) Ahmed, Y.A., El-hafez, A.A.E. and Zayed, A.E. 2009. Histological and histochemical studies on the esophagus, stomach and small intestine of Varanus niloticus. Journal of Veterinary Anatomy. 2(1): 35-48.
2) Chiu, H. and Lagunoff, D. 1972. Histochemical comparison of vertebrate mast cells. Histochemical Journal., 4: 135-144.
3) Conour, J.E., Ganessunker, D., Tappenden, K.A., Donovan, S.M. and Gaskins, H.R. 2002. Acidomucin goblet cell expansion induced by parenteral nutrition in the small intestine of piglets. American Journal of Physiology: Gastrointestinal and Liver Physiology. 283: 1185–1196.
4) Davenport, J. and Clough, W. 1986. Swimming and Diving in Young Loggerhead Sea Turtles (Caretta caretta L.). Copeia, 1986(1): 53-57.
5) Eichholz, A. and Crane, R.K. 1965. Studies on the organization of the brush border in intestinal epithelial cells. Journal of Cell Biology. 1965(26): 687-691.
6) Ernst, C.H. and Lovich, J.E. 2009. Turtles of the United States and Canada. 2nd edition. Baltimore, Maryland, Estados Unidos de América: The Johns Hopkins University Press.
7) Ferri, S., Junqueira, L. C., Medeiros, L. F. and Mederios, L. O. 1976. Gross, microscopic and ultrastructural study of the intestinal tube of Xenodon merremii Wagler, 1824 (Ophidia). Journal of anatomy.121( 2): 291-301.
8) García del Moral, R. 1993. Laboratorio de Anatomía Patológica. Madrid, España: McGraw-Hill-Interamericana de España.
9) Grimelius, L. 2004. Silver Stains demonstrating neuroendocrine cells. Biotechnic & Histochemistry. 7(3): 7-44.
10) Holmberg, A., Kaim, J., Persson, A., Jensen, J., Wang, T. and Holmgren, S. 2002. Effects of digestive status on the reptilian gut. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 133(3): 499-518.
11) Integrated Taxonomic Information System. 2000. Integrated Taxonomic Information System on-line database. Accessed 2013 Oct 23rd. http://www.itis.gov.
12) International Committee On Veterinary Gross Anatomical Nomenclature. 2012 Nomina Anatomica Veterinaria. Fifth edition. World Association of Veterinary Anatomist Editorial Committee.
13) Kakizoe, Y., Sakaoka, K., Kakizoe, F., Yoshii, M., Nakamura, H., Kanou, Y. and Uchida I. 2007. Successive changes of hematologic characteristics and plasma chemistry values of juvenile loggerhead turtles (Caretta caretta). Journal of Zoo and Wildlife Medicine. 38(1): 77-84.
14) Kotze, S. H., Van der Merwe, N. J., Van Aswegen, G. and Smith, G. A. 1992. A light microscopical study of the intestinal tract of the Nile crocodile (Crocodylus niloticus Laurenti 1768). Onderstepoort Journal of Veterinary Research. 59: 249-252.
15) Kushnir-Sukhov, N.M., Brown, J.M., Wu, Y., Kirshenbaum, A. and Metcalfe D.D. 2007. Human mast cells are capable of serotonin synthesis and release. Journal of Allergy and Clinical Immunology. 119: 498–499.
16) Lundqvist, M., Arnberg, H., Candell, J., Malmgren, M., Wilander, E., Grimelius, L. and Öberg K. 1990 Silver stains for identification of neuroendocrine cells. A study of the chemical background. The Histochemical Journal. 22(11): 615-623.
17) Mc Manus, J.F.A. 1948. Histological and histochemical uses of periodic acid. Stain Technology. 23: 99–108.
18) Magalhaes, M dos S., Barsante Santos, A.J., Da Silva, N.B. and De Moura, C.E.B. 2012 Anatomy of the digestive tube of sea turtles (Reptilia: Testudines). Zoologia. 29(1): 70-76.
19) Martínez, T. Viloria, M., Camacho, J., Godoy, R., Herrera, E. and Muñoz, R. 2004. Aspectos histológicos del intestino de Typhlonectes venezuelensis (Amphibia: Gymnophiona, Typhlonectidae). Revista Científica. 13(3): 237-243.
20) Moitra, M., Singh, O.K. and Munshi, J.S.D. 1989. Microanatomy and cytochemistry of the gastro-respiratory tract of an air breathing cobitid fish, Lepidocephalicthys guntea. Japan Journal of Ichthyology. 36: 227-31.
21) Mowry, R.W. 1956. Alcian blue techniques for the histochemical study of acidic carbohydrates. Journal of Histochemistry and Cytochemistry. 4: 407.
22) Neutra, M. and Leblond, C.P. 1966. Synthesis of the carbohydrate of mucus in the golgi complex as shown by electron microscope radioautography of goblet cells from rats injected with glucose-H3. The Journal of Cell Biology. 30(1): 119-136.
23) Nieuw, A.A.V., Bolscher, J.G.M., Bloemena, E. and Veerman, E.C. 1998. Sulfomucins in the human body. Journal of Biological Chemistry. 379: 1-18.
24) Park, J.Y., Kim, I.S. and Kim, S.Y. 2001. Morphology and histochemistry of the mud loach, Misgurnus mizolepis, in relation to cutaneous respiration. Korean Journal of Biological Sciences. 5: 303-8.
25) Pearse, A.G.E. 1960. Histoquímica, Teórica y Aplicada. Madrid, España: Aguilar.
26) Perez-Tomas, R., Ballesta, J., Madrid, J. F., Pastor, L. M. and Hernandez, F. (1990), Histochemical and ultrastructural study of the digestive tract of the tortoise Testudo graeca (Testudines). Journal of Morphology. 204: 235-245.
27) Pritchard, P.C.H. 1979. Encyclopedia of turtles. New Jersey, Estados Unidos: TFH.
28) Prophet, E.B. Mills, B. Arrington, J.B. and Sobin L.H. 1995. Métodos Histotecnológicos del Instituto de Patología de las Fuerzas Armadas de los Estados Unidos. Washington D.C., Estados Unidos: Registro de Patología de los Estados Unidos.
29) Rambourg, A., Hernandez, W. y Leblond C.P. (1969). Detection of complex carbohydrates in the golgi apparatus of rat cells. The Journal of Cell Biology. 40: 395-410.
30) Rambourg, A. 1971. Glycoproteins at the surface of animal cells. International Review of Cytology. 31: 57-114.
31) Robertson, A.M. and Wright, D.P. 1997. Bacterial glycosulphatases and sulphomucin degradation. Canadian Journal of Gastroenterology. 11: 361-366.
32) Rogers, H.J. 1961. The structure and function of hyaluronate. The Biochemical Society Symposia. 20: 51-78.
33) Singh, B.R., Guha, G. and Munshi J.S.D. 1974. Mucous cells of the respiratory sac in an air-breathing fish, Saccobranchus fossilis (Bloch). La Cellulae. 70: 1-15.
34) Spotila, J.R. 2004. Sea Turtles: A Complete Guide to their Biology, Behavior, and Conservation. Maryland, Estados Unidos de América: The Johns Hopkins University Press and Oakwood Arts.
35) Thompson, S.M. 1980. A comparative study of the anatomy and histology of the oral cavity and alimentary canal of two sea turtles: the herbivorous green turtle Chelonia mydas and the carnivorous loggerhead turtle Caretta caretta (includes discussion of diet and digestive physiology). Tesis de Maestría. Townsville, Australia, James Cook University of North Queensland.
36) Timmermans,J.P., Scheuermann, D.W., Gabriel, R., Adriaensen, D., Fekete, E. and De Groodf-Lasseel, M.H.A. 1991. The innervation of the gastrointestinal tract of a chelonian reptile, Pseudemys scripta elegans. I. Structure and topography of the enteric nerve plexuses using neuron-specific enolase imnunohistochemistry. Histochemistry, 95: 397-402.
37) Tso, P., Pitts, V. and Granger, D.N. 1985. Role of lymph flow in intestinal chylomicron transport. American Journal of Physiology-Gastrointestinal and Liver Physiology, 249(1): 21-28.
38) Tso, P. and Balint, J.A. 1986. Formation and transport of chylomicrons by enterocytes to the lymphatics. American Journal of Physiology-Gastrointestinal and Liver Physiology. 250(6): 715-726.
39) Wyneken, J. 2001. The Anatomy of Sea Turtles. Florida, Estados Unidos de América: Department of Commerce NOOA.
40) Yamabayashi, S. 1987. Periodic acid—Schiff—Alcian Blue: A method for the differential staining of glycoproteins. The Histochemical Journal. 19(10-11): 565-571.
License

Veterinaria México OA por Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México se distribuye bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Basada en una obra en http://www.revistas.unam.mx
- Todos los artículos en Veterinaria México OA se publican bajo una licencia de Creative Commons Reconocimiento 4.0 Unported (CC-BY 4.0). Con esta licencia, los autores retienen el derecho de autor, pero permiten a cualquier usuario compartir, copiar, distribuir, transmitir, adaptar y hacer uso comercial de la obra sin necesidad de proporcionar un permiso adicional, siempre y cuando se otorgue el debido reconocimiento al autor o fuente original.
- Al utilizar esta licencia, los artículos en Veterinaria México OA cubren o exceden todos los requisitos fundacionales e institucionales para ser considerados de Acceso Abierto.
- Los autores no pueden utilizar material protegido por derechos de autor en su artículo a menos que ese material esté también disponible bajo una licencia igualmente generosa.